G蛋白偶联受体(GPCR)家族是人类基因中最大的膜蛋白受体家族,参与调控人类各项生理功能,是非常重要的药物靶点。在识别来自细胞外的信号后,GPCR发生构象变化,结合并且激活异源G蛋白三聚体(α,β和γ亚基) ,从而引发下游的信号传递。具体的信号通路取决于α亚基的种类。Gα亚基主要含有四种亚型:Gαs, Gαi/o, Gαq/11和Gα12/13。早期研究发现大部分的GPCR可以选择性地激活一种Gα亚型,但是由于GPCR结构和功能的复杂性,很难找到其选择性识别Gα亚型的特征性氨基酸序列,因此目前人们对很多GPCR识别Gα亚型的分子机制的了解还十分有限。
2022年5月21日,PG电子-PG电子官方直营平台
/北京生命科学研究所郑三多实验室在Proceedings of the National Academy of Sciences (PNAS)杂志上发表题为“Structural insights into galanin receptor signaling”的研究论文。该研究揭示了甘丙肽受体亚家族成员(galanin receptors, GALRs)识别天然配体以及G蛋白的分子基础,此外还发现了Zn2+是GALR受体的负向别构调控配体,抑制GALR的信号传递。
甘丙肽(Galanin)是一种神经肽,广泛分布于神经系统中,参与调控多项生理活动,如能量代谢、疼痛、癫痫以及睡眠。它可以激活三种不同的GPCR:GALR1、GALR2以及GALR3。虽然这三个GALRs能够识别相同的配体,但是激活不同的G蛋白亚型。GALR1和GALR3主要激活Gi/o信号通路,导致cAMP水平的下降,而GALR2激活Gq/11,导致细胞质中IP3和钙离子的水平升高(图1A) 。为了了解GALR识别配体和G蛋白的分子机制,研究人员通过冷冻电镜方法解析了结合甘丙肽的GALR1‒Go和GALR2‒Gq的复合物结构 (图1B和1C) 。
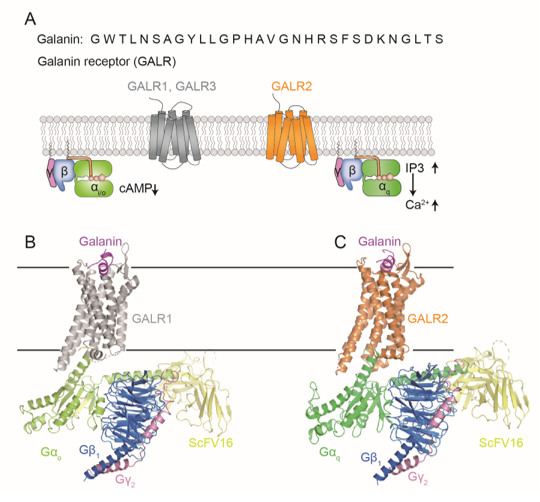
图1.甘丙肽受体/G蛋白/甘丙肽复合物的结构。
通过对GALR家族结构的分析,研究人员观察到了不寻常的受体-配体结合模式和信号转导特点。首先,作为一个天然配体,甘丙肽以近乎平行于细胞膜的结合方式“躺”在GALR的顶部,不同于大多数肽类配体垂直插入受体口袋的模式,也不同于大多数小分子配体深入受体内部的特点(图2) 。这样的结合更接近某些受体的正向别构调节分子所采用的方式。
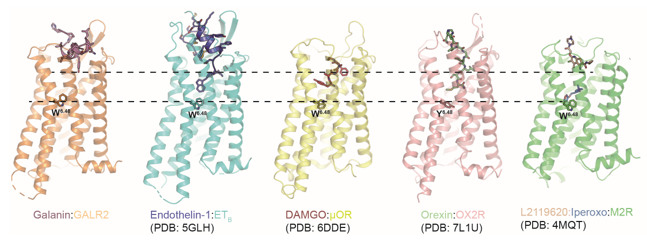
图2.甘丙肽独特的识别机制。
研究人员通过比较GALR1-Go和GALR2-Gq的复合物结构,观察到GALR受体与不同G蛋白结合的界面不完全相同(图3A和3B) 。GALR2主要通过其胞内ICL2 (Second intracellular loop) 区段结合Gαq蛋白 (图3C和3D) ,而GALR1通过ICL3区段结合Gαo蛋白。GALR2的ICL2上负责结合Gq的关键位点在GALR1中的对应位置也产生了替换(图3G),而GALR1的ICL3上与Gαo结合的关键位点在GALR2中发生了改变(图3H) 。研究人员进一步证实了将GALR1的ICL2上三个关键氨基酸,S14034.50、R14134.51和S1494.49分别突变为GALR2对应的残基之后,GALR1获得了偶联Gq的能力(图3I) ,而GALR2的ICL3被GALR1相对应的序列替换后与Go的结合能力明显增强 (图3J) 。
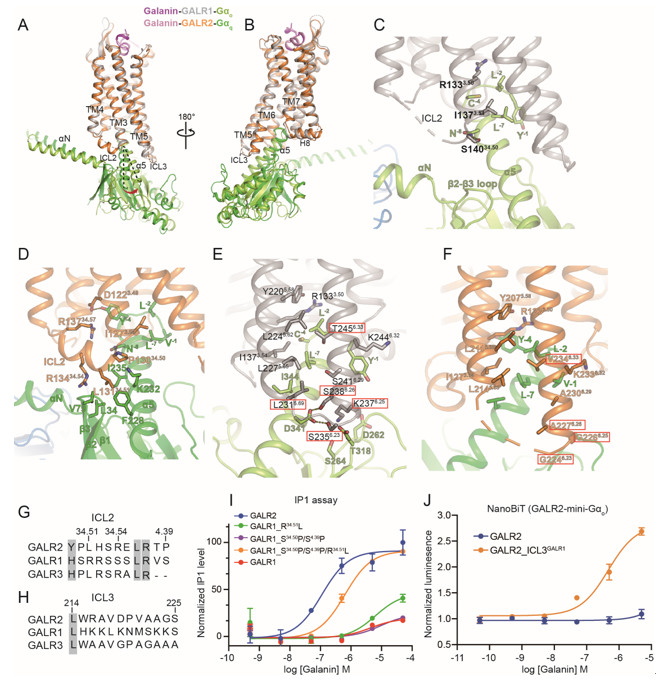
图3.GALR受体识别Go以及Gq的分子基础。
以前的研究发现Zn2+可以抑制甘丙肽与其受体的结合。Zn2+作为一种重要的神经递质,广泛存在于神经系统中,但是其具体的生理功能仍然不清楚。随后研究者进一步证实Zn2+可以特异性地抑制甘丙肽对GALR1的激活而对GALR2的影响非常小(图4A) 。通过细致的结构分析,发现在GALR1配体结合位置的下方含有大量的组氨酸 (图4B) ,组氨酸常常参与金属离子的配位结合。进一步的功能实验确定了H2676.55位点是Zn2+发挥调节作用所必需的 (图4C和4D) 。这个位点在不同物种的GALR1基因中高度保守,但在同家族的GALR2中被替换为疏水的异亮氨酸,表明Zn2+对GALR1特异的调节作用。
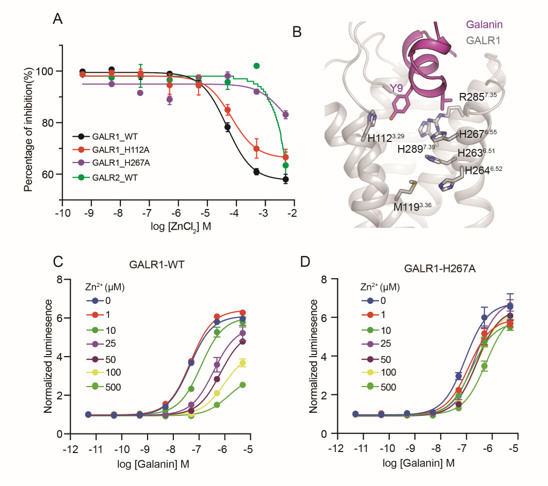
图4.锌离子对GALR1激活的抑制作用。
郑三多实验室的博士研究生蒋文通为本文的第一作者,郑三多博士为本文通讯作者。该研究由科技部、北京市政府和清华大学共同资助。
论文链接:
//www.pnas.org/doi/abs/10.1073/pnas.2121465119